Qué es una solución?



c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.

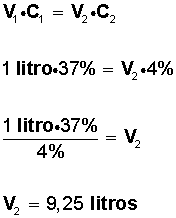
Entonces, si tenemos un litro de solución al 37%; para obtener una solución al 4% es necesario tener un volumen de 9,25 litros; por lo tanto, para saber cuantos litros de agua hay que agregar al litro inicial, hacemos:


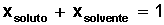
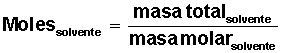
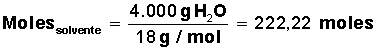
Para la sal (NaCl) su masa molar = M(NaCl) = 58,5 g/mol (1 mol de sal equivale a 58,5 g, formados por 23 g de Na y 35,5 g de Cl)
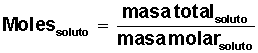
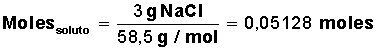
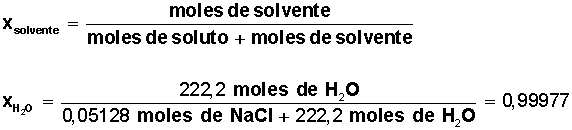
Fracción molar del soluto= Xsoluto

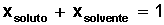
Entonces: 0,99977 + 0,00023 = 1

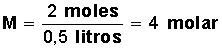

Una solución (o disolución) es una mezcla de dos o más componentes, perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales. Esto último significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida o gas) bien definida.
Una solución que contiene agua como solvente se llama solución acuosa.
Si se analiza una muestra de alguna solución puede apreciarse que en cualquier parte de ella su composición es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se consideran como soluciones.
Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el agua
Características de las soluciones (o disoluciones):
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
III) Los componentes de una solución son soluto y solvente.

Soluto es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
Solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua.
IV) En una disolución, tanto el soluto como el solvente interactúan a nivel de sus componentes más pequeños (moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la imposibilidad de separar sus componentes por métodos mecánicos.
Tipos de soluciones
Dependiendo de la cantidad
de soluto, las soluciones pueden ser:
§ Soluciones diluídas: La cantidad del soluto es
muy pequeña
§ Soluciones concentradas: La
cantidad de soluto es muy grande
§ Soluciones saturadas: En
soluciones en que se aumenta la cantidad de soluto a mayor temperatura
§ Soluciones
sobresaturadas: Cuando la solución tiene
más soluto que solvente
Propiedades
La concentración de soluto
es variable
§No es posible establecer
diferencias entre el soluto y el solvente porque son sistemas homogéneos
§La composición química del
soluto no se altera cuando se utiliza solvente inerte como el agua.
§Las propiedades físicas de
una solucion son diferentes a las del solvente puro
Solubilidad
§ Es una medida de la
capacidad de disolverse una determinada sustancia en un determinado solvente,
se corresponde con la máxima cantidad de soluto disuelto en una dada cantidad
de solvente a una temperatura fija
§ No todas las sustancias se
disuelven en un mismo solvente, por ej: en el agua se disuelve la mayor cantidad de solutos, pero el
aceite o gasolina no se disuelven.
§ El término solubilidad se
utiliza tanto para designar el fenómeno
cualitativo del proceso de disolución como para expresar cuantitativamente la
concentración de las disoluciones
Rapidez de disolución de sólidos
Los factores que determinan
la velocidad de disolución son:
1.- Factores que dependen
del medio de disolución:
-Intensidad de la agitación
-Temperatura
-Composición del medio: pH, viscosidad, presencia de absorventes, tensión superficial,
sales, etc.
-2.- Factores que dependen del sólido a disolver:
-Naturaleza química (sal, ácido, éster, etc)
-Presencia de impurezas
-Tamaño de las partículas
-Porosidad
Diluciones y neutralización
§ Una reacción de
neutralización es una reacción entre un ácido y una base, generalmente en las
reacciones acuosas ácido-base se forma agua y una sal, un ej: es el producto de la
reacción ácido- base del HCl con Na(OH):
§ HCl + Na(OH) = NaCl + H2O
§ Las soluciones acuosas son buenos conductores debido a la presencia
de iones positivos y negativos, a estos compuestos se los llama electrolito
Concentración de las soluciones en unidades físicas y químicas
Existen distintas formas de
expresar la concentración de una disolución, las mas utilizadas son:
1.- Unidades físicas:
§Peso/peso (g/g)
§Peso/volumen (g/ml, g/L)
§Volumen/volumen (ml/ml)
2.-Unidades químicas:
§Molaridad (M)
§Molalidad (m)
§Normalidad (N)
MODO DE EXPRESAR LA CONCENTRACION
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.

b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
Ejercicio:
Se tiene un litro de solución al 37%. ¿Cuántos litros de agua se tienen que agregar para que quede al 4%?
Resolvamos:
El problema no indica las unidades físicas de concentración. Se supondrá que están expresadas en % P/V.
Datos que conocemos: V = volumen, C= concentración
V1 = 1 litro
C1 = 37%
37% P/V = significa que hay 37 gramos de soluto en 100 ml de solución (solución = soluto + solvente).
C2 = 4%
V2 = ¿?
Regla para calcular disoluciones o concentraciones
V1 • C1 = V2 • C2
Puede expresarse en: % P/V
Reemplazando los datos que se tienen del problema, se obtiene:
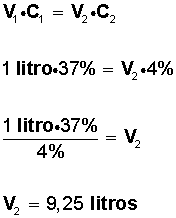
Entonces, si tenemos un litro de solución al 37%; para obtener una solución al 4% es necesario tener un volumen de 9,25 litros; por lo tanto, para saber cuantos litros de agua hay que agregar al litro inicial, hacemos:
V2 – V1 = Volumen de agua agregado
9,25 – 1 = 8,25 litros
Respuesta: Se deben agregar 8,25 litros de agua
Unidades químicas de concentración
Para expresar la concentración de las soluciones se usan también sistemas con unidades químicas, como son:
a) Fracción molar
b) Molaridad M = (número de moles de soluto) / (1 litro de solución)
c) Molalidad m = (número de moles de soluto) / (1 kilo de solvente)
a) Fracción molar (Xi): se define como la relación entre los moles de un componente (ya sea solvente o soluto) de la solución y los moles totales presentes en la solución.
Ejercicio:
Se agregan 3 gramos de sal en una cacerola con 4 litros de agua ¿cuál es la concentración de sal?, o dicho de otra forma ¿cuál es la concentración de la solución?
Calcular la fracción molar de solvente y de soluto: Recordemos que la fracción molar expresa la concentración de una solución en Moles de Soluto o de Solvente por Moles Totales de la Solución.
Solvente: agua (H2O)
Soluto: sal (NaCl)
Datos que conocemos: 3 gramos de soluto y 4.000 cm3 (4 litros) de solvente.
Con estos datos debemos resolver el problema, calculando 4 valores significativos: moles de solvente, moles de soluto, fracción molar de solvente y fracción molar de soluto.
Para el agua, se conoce su masa molar = M(H2O) = 18 g/mol (1 mol de H2O contiene 18 g, formados por 2 g de H y 16 g de O).
Averiguar cuántos moles de solvente H2O) tenemos:
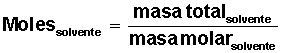
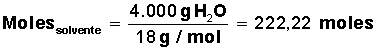
Para la sal (NaCl) su masa molar = M(NaCl) = 58,5 g/mol (1 mol de sal equivale a 58,5 g, formados por 23 g de Na y 35,5 g de Cl)
Averiguar cuántos moles de soluto tenemos:
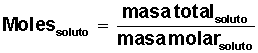
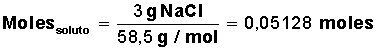
Ahora que conocemos la cantidad de moles de solvente y la cantidad de moles de soluto, podemos calcular las fracciones molares de solvente y de soluto:
Fracción molar del solvente = Xsolvente
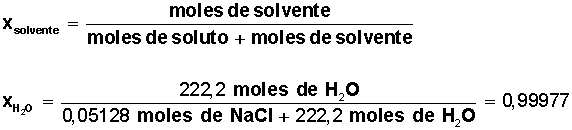
Fracción molar del solvente (agua) = 0,99977
Fracción molar del soluto= Xsoluto

Fracción molar del soluto= 0,00023
Pero sabemos que:
Entonces: 0,99977 + 0,00023 = 1
b) Molaridad (M): Es el número de moles de soluto contenido en un litro de solución. Una solución 4 molar (4 M) es aquella que contiene cuatro moles de soluto por litro de solución.
Ejercicio:
¿Cuál será la molaridad de una solución que contiene 64 g de Metanol (masa molar del metanol 32 gr/mol) en 500 ml de solución?
Datos conocidos: metanol 64 g
Masa molar del metanol: 32 g/mol
Masa de la solución: 500 ml (0,5 litro)
Primero calculamos la cantidad de moles que hay en 64 g de metanol.
Si un mol de metanol equivale a 32 g, 64 g equivalen a 2 moles (64/32=2)
Aplicamos la fórmula:
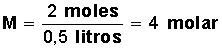
Respuesta: 4 molar
c) Molalidad
En primer lugar debemos advertir que molalidad no es lo mismo que molaridad por lo cual debemos evitar confundirlas puesto que el nombre es muy parecido pero en realidad cambian mucho los cálculos, y es un grave error pero muy frecuente.
En la molalidad relacionamos la molaridad del soluto con el que estamos trabajando con la masa del disolvente (en kg) que utilizamos.
La definición de molalidad es la siguiente:
Relación entre el número de moles de soluto por kilogramos de disolvente (m)

Soluciones en la industria riobambeña.
- En la industria riobambeña es muy importante la aplicación de soluciones químicas ya que más del 90% de las reacciones químicas ocurren en soluciones.
- Se aplican soluciones tanto en el campo farmacéutico, en la alimentación, en la fabricación de diferentes productos como cremas, gel, jabones y perfumes, etc

- La creación de cremas, dentríficos, cosméticos, etc, es necesario hacer soluciones.
- Para extraer colorantes o aceites esenciales es necesario disolver las plantas en diversos compuestos orgánicos.
- Las cerámicas se hacen a base de soluciones sólidas.
- Las pinturas son soluciones.
Explicación general
Linkografía
http://www.profesorenlinea.cl/Quimica/Disoluciones_quimicas.html
http://solucionequimicasdianaleon.blogspot.com



Muy buena información :)
ResponderBorrarme sirvio de mucho gracias
ResponderBorrarbuen trabajo
ResponderBorrarbien resumido y entendible
ResponderBorrarinteresante el tema ....excelente...!!!
ResponderBorrarla informacion esta clara y precisa
ResponderBorrarTodo muy claro muchas gracias felicitaciones.
ResponderBorrarExcelente contenido.
ResponderBorrarel contenido esta resumido y claro excelente trabajo!!!
ResponderBorrarbuen trabajo muy bien resumido
ResponderBorrarBuen trabajo, me sirvió para aclarar muchas dudas :)
ResponderBorrarun exelente trabajo, la informacion muy clara
ResponderBorrarbuen trabajo paito ! facil de entender
ResponderBorrarmuy buen trabajo pao!! facil de entender!! sigue asi!
ResponderBorrarGracias por la información esta concreta y resumida
ResponderBorrar